離子層析的要點 …… pH 值很麻煩
離子層析法通常用於分析水中帶電狀態的元素離子和低分子離子。
離子可分為無機離子、有機酸離子、胺類等。
進行離子層析分析時,必須注意分析環境。有離子的環境 (pH 值的差異) 可能會改變離子性 (電荷狀態)。
在此介紹幾個離子層析的案例,重點放在 pH 值。
(1) 溶劑 pH 值對離子層析很關鍵!
來自強酸或強鹼的一般無機離子,以陽離子或陰離子的形式存在於水中。為了達到合適的洗脫強度,離子層析結合酸和鹼作為流動相。將 pH 值範圍 3 至 11 的樣品進樣到離子層析儀時,可以進行幾乎完全解離的穩定分析。
有機酸和胺類 (銨等) 各有其固有的酸解離常數 (pKa)。對於這些物質,溶劑 pH 值和樣品濃度會改變解離 (離子狀態) 和非解離狀態之間的平衡,進而改變可被離子層析檢測到、以離子狀態存在之物質的比例。對於一些分析條件和分析 (檢測) 方法,可能無法獲得線性的校正曲線。
(2) 離子層析方法和 pH 值
離子層析可以使用非抑制法或抑制法,差別不僅在於是否安裝抑制器,在化學上也有差異。以下將使用範例說明。
非抑制法通常使用弱酸性緩衝溶液或酸的水溶液作為流動相。流動相製備好後,其成分和 pH 值在分析管柱和檢測器容維持不變。由於流動相的緩衝比例和 pH 值,目標離子在完全解離的狀態下分離和檢測,並且濃度和電導率之間為線性關係。
而抑制法方面,由於目標離子的相對離子在檢測器之前立即消除以降低流動相的背景電導率,因此在分離和檢測過程的流動相組成不同。
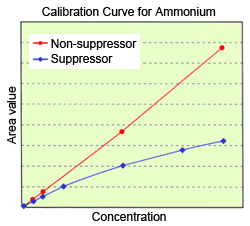
由於這種組成的變化會改變 pH 值,因此在分析有機酸和胺類 (銨等) 時,必須特別注意這種變化對解離狀態的影響。離子層析使用抑制法時,已知銨離子的校正曲線會彎曲。
(3) 務必留意胺類的校正曲線!
銨處於以下的平衡狀態。
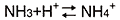
狀態會隨著流動相的 pH 值而變化。在酸性條件下,平衡向右移動,NH4+ i的豐度比增加。然而隨著 pH 值的增加,NH4+ 會減少。在高流動相 pH 條件下,隨著樣品濃度的升高,解離抑制程度更高,NH4+ 豐度比降低。這打破了濃度與反應之間的比例關係,造成校正曲線彎曲。
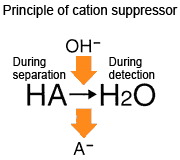
陽離子抑制法使用酸的水溶液 (例如硫酸或甲磺酸) 作為流動相。硫酸根離子和甲磺酸根離子在抑制器內轉化為 OH 離子,因此抑制器的洗脫液為水 (pH 7)。
結果發生上述現象,校正曲線彎曲。如果抑制器效率較高,效果會更加明顯。這種現象通常不會發生在非抑制法,因為非抑制法使用的是酸性流動相。
(4) 分析有機酸時,要注意 pH 值!
以下介紹以陰離子抑制法分析有機酸的範例。抑制法的流動相使用碳酸鈉或碳酸氫鈉的水溶液,流動相的 pH 值超過 9,有機酸在幾乎完全解離的狀態下分離,此時幾乎全部的有機酸在檢測器中都被檢測為離子。然而,由於抑制器中流動相的背景電導率降低,流動相中的鈉離子由氫離子取代。
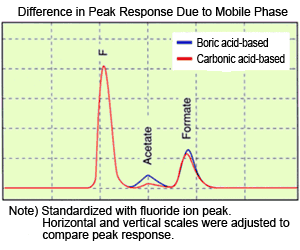
因此,檢測期間流動相 (抑制器洗脫液) 變為弱酸性的碳酸水,pH 值為 5 或 6。由於有機酸具有羧基,pKa 約為 4.5,接近檢測時的流動相 pH 值,可以略微抑制解離。本圖說明使用碳酸和硼酸基流動相時,乙酸和甲酸的峰值反應差異。硼酸基流動相通過抑制器後,變為 pH 值 6 或 7 的硼酸水。
氟化物、乙酸和甲酸樣品以相同濃度製備。相較於碳酸基流動相,硼酸基流動相對乙酸和甲酸的峰值反應更高。此外,可以看出乙酸的反應變化大於甲酸,這是因為乙酸和甲酸的 pKa 分別約為 4.5 和 3.5,隨著流動相 pH 值進一步偏離 pKa,解離增加,所以具有較高 pKa 的乙酸由於從碳酸基流動相轉換到硼酸基流動相,而更容易受到 pH 值變化的影響。(Ie)