藥物元素雜質分析系統 - 配備選項
Pharmaceutical Elemental Impurities Analysis System
PCEDX for Part 11 DB (獨立資料庫版本)
內容
- 媒體 (PCEDX for Part 11 安裝程式、LabSolutions DB 連接套件、說明手冊、PDF 建立工具)
- 軟體授權安裝手冊
PCEDX for Part 11 CS (用戶端伺服器版本)
內容
- 媒體 (PCEDX for Part 11 安裝程式、LabSolutions CS 連接套件、說明手冊)
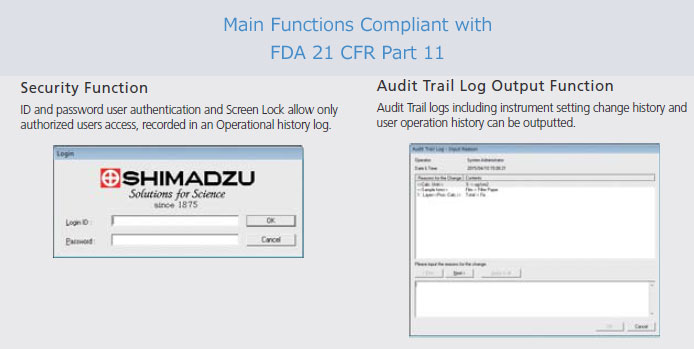
製藥產業所需的 FDA 21 CFR Part 11 合規特色
提供符合 FDA 21CFR Part 11 的以下功能。
- 安全功能
- 使用者權限管理
- 驗證功能
- 操作和稽查證跡日誌輸出功能
- PDF 資料輸出
LabSolutions DB/CS 資料管理 - 更高效率
內容
所有分析資料,包括從其他分析儀器取得的資料,會在伺服器電腦上的資料庫中管理,可在網路上的任何電腦載入和管理資料。
藥品雜質分析方法套件
內容
- 條件媒體 (藥品雜質分析條件檔案) (重疊修正量測條件檔案)
- 藥品雜質分析說明手冊 (PDF 格式)
Cd、Pb、As、Hg、Co、V、Ni、Pd、Ir、Rh、Ru 和 Pt 的分析
包含 ICH Q3D 規定的 24 種元素中,需要風險評估的 12 種重要元素。
使用背景內部標準品修正方法之校正曲線條件
此方法修正樣品數量、型態和基質差異導致的定量誤差。
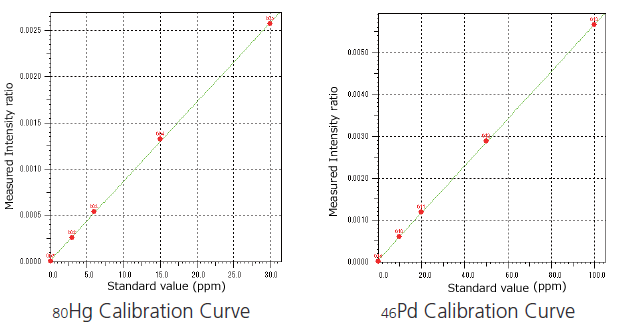
註:套件中未包含用於建立校正曲線的標準混合物溶液。另購以下項目。
SPEX CertiPrep (USA)
- XSTC-2046 (Cd, Pb, As, Hg, Co, V, Ni)
- USP-TXM 4 (Pd, Ir, Rh, Ru, Pt)


